前列腺中发现子宫内膜组织的跨性别女性血精症病例
Received 29 August 2023, Revised 9 January 2024, Accepted 17 January 2024, Available online 24 January 2024, Version of Record 16 May 2024.
引言
血精症(定义为肉眼可见带血或血性精液)较为罕见且通常具有自限性。尽管患者常感担忧,但血精症多属良性病变[1]。精液中肉眼可见的血液可能为特发性,或由泌尿外科手术医源性导致,亦可能源于炎症(如性传播感染、结核分枝杆菌疾病)、系统性高血压、出血、精囊结石、前列腺/射精管囊肿、钙化、副中肾管残余及前列腺癌等[2]。年龄>40岁且具有高危因素(如症状反复、血尿、前列腺癌病史)的患者需转诊至泌尿外科[3]。泌尿外科手术史与血精症发病率升高相关,但其在普通人群中的发生率尚不明确[4]。此外,现有文献尚未记录接受性别肯定激素治疗(GAHT)的跨性别女性中血精症的发病率或临床表现。本报告呈现一例出现血精症的跨性别女性病例,并探讨该患者病情的潜在发展机制。
病例报告
一名35岁跨性别女性主诉无痛性铁锈色精液及射精后间歇性尿道出血,伴1年间歇性血尿。既往有胃食管反流病、内痔及注意缺陷多动障碍病史。当前用药包括:戊酸雌二醇与亮丙瑞林(持续1年)、恩曲他滨-替诺福韦(用于HIV暴露前预防)及非索非那定(季节性过敏)。就诊前1.5年曾短期服用比卡鲁胺与黄体酮2个月,后因疲劳感停药。体格检查示患者神清、定向力正常,无急性痛苦面容。血压106/61 mmHg,体温98°F(36.7°C),呼吸频率16次/分,血氧饱和度88%,体重指数26.3 kg/m²。头颅无畸形,黏膜湿润清晰。心血管检查示心律齐,未闻及杂音或奔马律。双肺听叩诊清,无咳嗽、咳痰或实变征。肠鸣音正常,肋脊角压痛,无局灶性神经功能缺损。情绪、情感及思维内容正常。无泌尿系统病史,终身不吸烟。
为排除常见病因,患者接受多项评估。尿常规及培养示少量白细胞与革兰染色不定杆菌。衣原体、淋病及HIV检测均为阴性。腹部盆腔CT示前列腺形态正常,双侧肾盂输尿管无异常,无肾结石或近期排石证据。膀胱镜检查示尿道、膀胱颈及膀胱内壁正常,无梗阻、肿瘤、红斑、炎症、膀胱结石或憩室。初步检查后血精症与血尿仍持续存在。
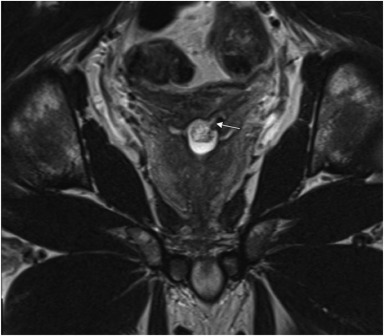
症状出现1年后,经直肠超声示前列腺大小正常,后正中线处见1.7 cm囊肿伴出血产物。前列腺MRI显示前列腺体积3.9×2.6×4.1 cm(总体积21.6 mL),后正中线1.7×1.4×1.7 cm囊肿与左侧精囊相通,未见前列腺癌征象(见图1)。
图1. 一名35岁出现血精症的跨性别女性,磁共振成像显示其前列腺后部有一个1.7厘米的囊肿,与左侧精囊相通。
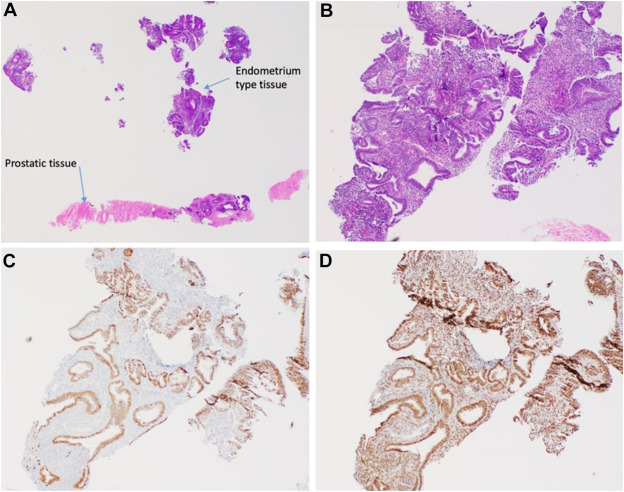
两次超声引导下经会阴穿刺活检结果显示为良性前列腺组织,其中可见局灶性苗勒管/子宫内膜样组织,免疫组化结果支持该诊断:
-
上皮细胞中配对盒基因8(PAX8)和雌激素受体(ER)染色阳性
-
间质中分化簇10(CD10)染色阳性
病理报告指出,这些发现可能提示子宫内膜异位症或苗勒管囊肿(图2 A-D)。
图2. 患者前列腺后部出血性囊肿的两次超声引导经会阴穿刺活检病理结果。组织病理学图像显示:
-
A、B:子宫内膜样组织的HE染色(A:20倍放大;B:40倍放大)
-
C、D:苗勒管/子宫内膜样组织特异性免疫染色(C:PAX8免疫染色;D:雌激素受体免疫染色)
患者接受了前列腺囊肿抽吸术、经尿道射精管切除术及睾丸切除术。抽吸物的组织病理学结果与先前活检相似。当含有子宫内膜样组织的前列腺囊肿被抽吸后,血精症症状消失。
睾丸切除标本的手术病理显示:
-
双侧睾丸萎缩
-
生精小管出现生精阻滞,未见精子细胞
-
左侧睾丸存在显著小管透明变性区域
术后患者未出现任何并发症。在经会阴活检六个月后,经医学评估批准其接受阴道成形术。
讨论
子宫内膜异位症在组织学上定义为子宫内膜样上皮、腺体及间质出现在子宫内膜和肌层以外的部位,其胚胎学起源可能为苗勒管或非苗勒管来源[5]。配对盒基因8(PAX8)免疫染色对苗勒管来源的上皮具有高度敏感性和特异性,而雌激素受体(ER)免疫染色通常在子宫内膜上皮中表达,使细胞在月经增殖期产生特异性反应(营养性和有丝分裂性)[6]。分化簇10(CD10)免疫染色在子宫内膜间质中呈阳性,但在卵巢间质中为阴性[7]。综合上述免疫染色模式,结果符合苗勒管来源的子宫内膜组织(含间质)。结合患者的临床病史和影像学中界限清晰的囊肿表现,可能提示为伴有子宫内膜分化(腺体与间质)的苗勒管囊肿或子宫内膜异位症。仅凭组织学和免疫组化结果难以区分这两者。磁共振成像显示的囊肿与左侧精囊的连通性可能解释了血精症的成因。
苗勒管组织(更具体而言,苗勒管)参与女性生殖系统内生殖器官的发育。虽然苗勒管最初存在于所有个体中,但若未受到Y染色体相关抗苗勒管激素(AMH)的作用(如顺性别女性的情况),苗勒管将发育为输卵管、子宫、宫颈和阴道近端1/3段。子宫内膜组织通常源自苗勒管干细胞,在具有典型内外男性解剖结构的顺性别男性中一般不出现,因其表达AMH[8]。尽管罕见,既往文献曾报道过顺性别男性的子宫内膜异位症病例,主要表现为腹痛[6,12-14]。其发病机制可能涉及长期雌激素暴露或炎症的后遗症[9] [10]。
本例患者因血精症伴发血尿(高危因素)接受了全面评估,因该症状可能与炎症、感染、梗阻、系统性疾病、创伤、血管异常及罕见的前列腺癌等多种病因相关[11]。患者检查结果均正常,促使我们探索其他解释,包括潜在的子宫内膜异位症(微观或宏观)或异位苗勒管上皮组织[12]。
子宫内膜异位症的诱导理论假说认为,异位子宫内膜组织源于胚胎组织的病理性改变[13]。理论上,若顺性别男性的苗勒管在AMH作用下未完全退化,可能残留原始组织。前列腺囊(男性苗勒管残余形成的上皮内衬结构)是位于前列腺尿道后部的小囊状凹陷,该区域可能存留具有分化潜能的苗勒管细胞。雌激素暴露、炎症或其他过程可能诱导这些细胞分化为子宫内膜组织。该理论与本例子宫内膜异位症位于前列腺后部的位置特征一致,也与大多数顺性别男性子宫内膜异位症病例报告相符[6]。
其他假说认为该病的病因还包括肝脏疾病或慢性术后炎症。免疫功能不足可能是诱因之一,这也被提出作为顺性别女性异位子宫内膜生长的另一机制。
对顺性别女性,子宫内膜异位症的治疗通常以症状为导向。一线治疗包括对乙酰氨基酚、非甾体抗炎药和复方激素避孕药,二线治疗则使用促性腺激素释放激素激动剂。对药物治疗无效的难治性病例需手术切除。恶性转化罕见,仅约1%的顺性别女性患者会发展为子宫内膜异位症相关卵巢癌[18]。因此,异位子宫内膜组织病史与较高的相对发病风险相关。值得探讨的是,接受女性化GAHT的跨性别女性是否具有不同的恶性转化率。
据我们所知,本病例可能是首例跨性别女性中发现子宫内膜组织的报道。接受GAHT的跨性别女性中,子宫内膜上皮和间质的实际存在可能超出既往认知。此外,本病例为反驳"经血逆流"理论(顺性别女性子宫内膜异位症的主要假说)提供了证据,并支持诱导理论更可能是潜在机制。
H. Fuse, A. Komiya, T. Nozaki, A. Watanabe Hematospermia: etiology, diagnosis, and treatment Reprod Med Biol, 10 (3) (2011), pp. 153-159, 10.1007/s12522-011-0087-4,M. Polito, W. Giannubilo, G. d’Anzeo, G.Muzzonigro Hematospermia: diagnosis and treatment Arch Ital Urol Androl, 78 (2) (2006), pp. 82-85,M.J. Mathers, S. Degener, H. Sperling, S.Roth Hematospermia-a symptom with many possible causes Dtsch Ärztebl Int, 114 (11) (2017), pp. 186-191, 10.3238/arztebl.2017.0186 ↩︎
H. Fuse, A. Komiya, T. Nozaki, A. Watanabe Hematospermia: etiology, diagnosis, and treatment Reprod Med Biol, 10 (3) (2011), pp. 153-159, ,D.E. Leocádio, B.S. Stein Hematospermia: etiological and management considerations Int Urol Nephrol, 41 (1) (2009), pp. 77-83,R.H. Drury, B. King, B. Herzog, W.J.G.Hellstrom Hematospermia etiology, diagnosis, treatment, and sexual ramifications: a narrative review Sex Med Rev, 10 (4) (2022), pp. 669-680 ↩︎
C. Rei, T. Williams, M. Feloney Endometriosis in a man as a rare source of abdominal pain: a case report and review of the literature Case Rep Obstet Gynecol, 2018 (2018), pp. 1-6, 10.1155/2018/2083121 ↩︎
M.J. Mathers, S. Degener, H. Sperling, S.Roth Hematospermia-a symptom with many possible causes Dtsch Ärztebl Int, 114 (11) (2017), pp. 186-191 ↩︎
A.S. Laganà, S. Garzon, M. Götte, et al. The pathogenesis of endometriosis: molecular and cell biology insights Int J Mol Sci, 20 (22) (2019), p. 5615 ↩︎
N.M.A. Masjeed, S.G.S. Khandeparkar, A.R.Joshi, M.M. Kulkarni, N. Pandya Immunohistochemical study of ER, PR, Ki67 and p53 in endometrial hyperplasias and endometrial carcinomas J Clin Diagn Res, 11 (8) (2017), pp. EC31-EC34 ↩︎
T. Toki, M. Shimizu, Y. Takagi, T. Ashida, I.Konishi CD10 is a marker for normal and neoplastic endometrial stromal cells Int J Gynecol Pathol, 21 (1) (2002), pp. 41-47 ↩︎
D. Wilson, B. Bordoni Embryology, mullerian ducts (paramesonephric ducts) StatPearls [Internet], StatPearls Publishing, R.D. Mullen, R.R. Behringer Molecular genetics of Müllerian duct formation, regression and differentiation Sex Dev, 8 (5) (2014), pp. 281-296 ↩︎
C. Rei, T. Williams, M. Feloney Endometriosis in a man as a rare source of abdominal pain: a case report and review of the literature Case Rep Obstet Gynecol, 2018 (2018), pp. 1-6 ↩︎
T.C. Pinkert, C.E. Catlow, R. Straus Endometriosis of the urinary bladder in a man with prostatic carcinoma Cancer, 43 (4) (1979), pp. 1562-1567, F.I. Jabr, V. Mani An unusual cause of abdominal pain in a male patient: endometriosis Avicenna J Med, 04 (04) (2014), pp. 99-101, G. Simsek, H. Bulus, A. Tas, S. Koklu, S.B.Yilmaz, A. Coskun An unusual cause of inguinal hernia in a male patient: endometriosis Gut Liver, 6 (2) (2012), pp. 284-285 ↩︎
D. Wilson, B. Bordoni Embryology, mullerian ducts (paramesonephric ducts) StatPearls [Internet], StatPearls Publishing, R.D. Mullen, R.R. Behringer Molecular genetics of Müllerian duct formation, regression and differentiation Sex Dev, 8 (5) (2014), pp. 281-296 ↩︎
A.S. Laganà, S. Garzon, M. Götte, et al. The pathogenesis of endometriosis: molecular and cell biology insights Int J Mol Sci, 20 (22) (2019), p. 5615 ↩︎
J.A. Rock, S.M. Markham Pathogenesis of endometriosis Lancet, 340 (8830) (1992), pp. 1264-1267 ↩︎