摘要
骨几何形态可通过骨膜生长和皮质内生长描述,其部分由性类固醇激素决定。现有理论认为,睾酮和雌激素分别调控骨膜成骨和皮质内成骨。跨性别者接受性别肯定激素治疗(gender-affirming hormone, GAH)可能影响骨几何形态,但成年跨性别者在GAH期间未观察到骨几何形态改变。本研究探讨了在峰值骨量达成前使用促性腺激素释放激素激动剂(GnRHa)和GAH的跨性别青少年的骨几何形态变化。
研究对象为18岁前接受GnRHa及后续GAH治疗的跨性别青少年,根据GnRHa启动时的Tanner分期分为青春期早、中、晚期组。通过髋部结构分析软件(应用双能X线吸收测定法扫描数据)计算骨膜下宽度(subperiosteal width, SPW)和皮质内直径(endocortical diameter, ED),扫描时间点为GnRHa启动时、GAH启动时及GAH治疗≥2年后。采用混合模型分析时序差异,并将数据与一般人群参考值进行可视化对比。
共纳入322名参与者(跨性别女性106人,跨性别男性216人)。结果显示:
青春期早期启动GnRHa的跨性别女性与男性,其SPW和ED变化趋势均趋近于experienced gender的参考曲线
青春期中期/晚期启动GnRHa者则始终维持出生指派性别参考曲线范围
潜在机制可能与"编程效应"(programming)有关——该理论认为发育关键窗口期的刺激会产生终身影响。本研究不仅为GnRHa治疗的跨性别青少年,也为普通人群的性别特异性骨几何形态发育提供了新见解。(© 2021 美国骨与矿物研究学会《骨与矿物研究杂志》)
关键词:髋骨几何形态,青春期,促性腺激素释放激素激动剂,跨性别,性别肯定激素治疗
J Bone Miner Res
. 2021 Feb 17;36(5):931–941. doi:10.1002/jbmr.4262
引言
在临床实践中,骨强度通常通过双能X线吸收测定法(DXA)测量,并以骨密度(BMD)表示。然而,早期研究指出,除BMD外,骨几何形态同样与骨强度相关(1,2)。结构性骨几何形态可通过骨膜宽度和皮质内宽度描述,其发育部分由性类固醇激素调控(3)。现有理论认为,骨膜成骨和皮质内成骨的主要调节因子分别为睾酮和雌激素(4-6)。另一关键影响因素是青春期启动时机——由于大部分骨量累积发生于该阶段,性别特异性的骨几何形态变化主要出现在青春期(7)。
近年来,跨性别青少年群体为研究性类固醇在青春期骨几何形态发育中的性别特异性作用提供了独特视角。这些青少年接受促性腺激素释放激素激动剂(GnRHa)抑制内源性青春期发育,随后通过性别肯定激素(GAH)诱导符合其性别体验的青春期。
跨性别者指出生指派性别与性别体验不一致的群体,这种不一致可能导致性别不安。GD可能在儿童早期即已出现,因此青春期第二性征发育对部分跨性别儿童可能构成心理创伤。为缓解这一问题,荷兰约20年前率先引入青春期抑制治疗(8,9),其标准方案为周期性GnRHa给药(10)。GnRHa通过过度刺激引发垂体GnRH受体下调,减少促性腺激素(黄体生成素与卵泡刺激素)分泌,进而诱导低促性腺激素性性腺功能减退状态,最终抑制青春期发育。当前内分泌学会的GD诊疗指南建议在Tanner 2期启动GnRHa治疗(11),经严格评估后,再通过GAH诱导符合性别体验的青春期发育:
-
跨性别女性(出生指派性别男性/性别认同女性):接受口服或经皮雌二醇治疗
-
跨性别男性(出生指派性别女性/性别认同男性):接受经皮或肌注睾酮治疗
需说明的是,该治疗方案尚未在全球范围内达成共识,部分国家禁止18岁前实施GAH。
既往研究表明,成年跨性别者在GAH治疗期间骨几何形态未发生改变(12),这可能与参与者已达成最终骨几何比例有关,但该假设尚未在青少年群体中验证。对跨性别青少年骨几何形态的研究具有双重意义:
-
为跨性别青少年健康管理中的骨强度发育提供依据
-
有助于理解不同青春期阶段性类固醇对骨发育的影响机制
我们提出假设:在儿童期接受青春期抑制剂及后续GAH治疗的跨性别者,其骨几何形态将更接近experienced gender而非出生指派性别。具体表现为:
-
跨性别女性(雌激素治疗):皮质内直径小于顺性别男性
-
跨性别男性(睾酮治疗):骨膜直径大于顺性别女性
由此引出的核心研究问题为:青少年期接受GnRHa与GAH治疗≥2年的跨性别者,其骨几何形态是否更接近所体验的性别?
鉴于骨几何形态的性别特异性变化是青春期渐进过程,我们进一步提出一个问题:这种改变是否取决于GnRHa治疗启动时的青春期阶段?
材料与方法
研究设计与人群
本研究采用阿姆斯特丹性别不安队列(Amsterdam Cohort of Gender Dysphoria)进行回顾性分析(13)。该队列纳入1972年至2018年12月期间就诊于阿姆斯特丹大学医学中心性别诊所的所有个体,其中1987年后的儿童及青少年数据被系统记录。数据库包含人口统计学信息、临床特征(如激素治疗起始年龄与青春期分期、治疗方案类型、人体测量学数据)及多项生化指标。作为常规医疗的一部分,受试者在治疗期间定期接受双能X线吸收测定(DXA)扫描。
纳入标准:
-
18岁前启动GnRHa单药治疗且持续≥6个月
-
在以下三个时间点至少各完成1次DXA扫描(允许±6个月的时间窗):
-
GnRHa治疗前(基线)
-
GAH启动时
-
GAH治疗≥2年后
-
-
若存在多次符合要求的GAH治疗后扫描,选取时间最晚者(但需在26岁前完成以确保GAH治疗时长一致性)
本研究经阿姆斯特丹自由大学医学中心伦理委员会审查,因属回顾性研究且未涉及额外干预措施,认定不符合《人体研究法案》(WMO)适用范围,故豁免知情同意要求。
医疗方案
跨性别青少年的治疗方案详见既往文献(14),简要流程如下:
-
诊断标准:符合《精神障碍诊断与统计手册第五版》(DSM-5)性别不安诊断
-
GnRHa启动:
-
跨性别男性(出生指派性别女性):Tanner乳房分期≥2期(通常约12岁)
-
跨性别女性(出生指派性别男性):Tanner生殖器分期2-3期
-
给药方案:曲普瑞林皮下注射(3.75 mg/4周或11.25 mg/12周)
-
-
GAH启动(约16岁):
-
跨性别女性:口服17-β雌二醇(起始剂量5 μg/kg/日,维持剂量2-4 mg/日)
-
跨性别男性:肌注睾酮酯混合物(起始剂量25 mg/m²体表面积,维持剂量250 mg/3-4周)
-
-
后续治疗:
-
18岁后且接受GAH≥1年者可评估性腺切除术指征
-
术后停用GnRHa
-
骨几何形态分析
传统DXA仅提供特定区域二维平均骨密度(BMD),无法反映矿物质空间分布或骨结构几何特征。本研究采用Beck等人(1989)开发的髋部结构分析(hip structure analysis, HSA)技术(15),通过APEX 4.0软件对非优势侧股骨近端DXA图像进行自动化处理,获取以下几何参数:
-
骨膜下宽度(subperiosteal width)
-
皮质内直径(endocortical diameter)
扫描设备:Hologic Discovery A型DXA仪(Hologic Inc., USA)
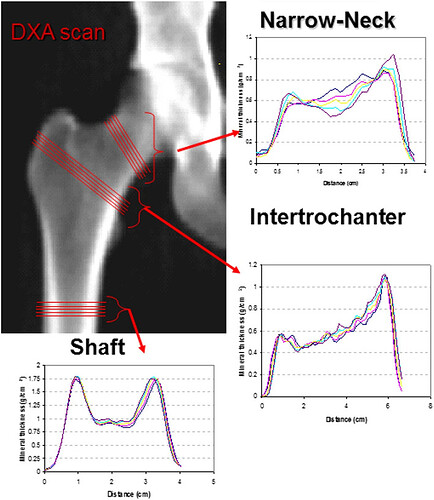
重点关注区域:股骨颈狭窄区、转子间区、股骨干(见图1)
图一
红色标记线显示髋部结构分析(HSA)的横截面定位及对应骨质量分布曲线。本图通过双能X线吸收测定法(DXA)获取,经Elsevier许可后转载自Beck等学者的研究成果(38)。
测量方法与质量控制
骨几何参数测量
在每个分析位点(股骨颈狭窄区、转子间区、股骨干),我们测量了以下两项关键指标:
-
骨膜下宽度(Subperiosteal Width)
- 定义:骨外膜两侧皮质层之间的最大距离。单位使用厘米(cm),通过HSA软件自动识别骨外膜边界距离。
-
皮质内直径(Endocortical Diameter)
- 定义:骨内膜两侧皮质层之间的最小距离,单位使用厘米(cm),使用软件自动检测骨内膜边界。
测量精度验证
通过重复测量体模数据计算变异系数(CV):骨膜下宽度的CV为1.1%,皮质内直径的CV为1.4%
纳入标准补充说明:由于本机构在2011年2月后才配备HSA分析软件,因此仅纳入在此日期之后至少完成1次扫描的参与者数据。
协变量采集
在DXA扫描时同步记录:
-
种族(通过DXA软件预设分类):
-
白人
-
非洲裔
-
西班牙裔*(翻译猜测:这里似乎指拉美裔)*
-
亚裔
-
-
体重指数(BMI):
-
计算公式:体重(kg)/[身高(m)]²
-
测量方式:采用医用身高体重仪直接测量
-
生长发育因素的校正
为区分治疗效应与自然生长的影响,我们引用已发表的普通青春期人群性别特异性HSA参数参考数据(16)。需说明的是:参考数据仅包含股骨颈狭窄区的测量值。数据按年龄和性别分层,用于建立预期生长曲线。
生化检测方法
激素测定
-
雌二醇检测
-
2014年7月前:采用DELFIA竞争性免疫分析法(Wallac公司,芬兰)定量下限(LOQ):20 pmol/L,批间变异系数(CV):10%
-
2014年7月后:改用液相色谱-串联质谱法(LC-MS/MS,阿姆斯特丹VUmc医学中心)LOQ:20 pmol/L,批间CV:7%
-
单位换算:LC-MS/MS值 = 1.60 × DELFIA值 - 29
-
-
睾酮检测
-
2013年1月前:采用Coat-A-Count放射免疫分析法(Siemens公司,美国)LOQ:1 nmol/L,批间CV:7%-20%
-
2013年1月后:改用Architect竞争性免疫分析法(Abbott公司,美国)LOQ:0.1 nmol/L,批间CV:6%-10%
-
单位换算:睾酮<8 nmol/L时:Architect值 = 1.1 × RIA值 + 0.2,睾酮>8 nmol/L时:Architect值 = 1.34 × RIA值 - 1.65
-
统计分析
数据描述
-
正态分布数据:均值±标准差
-
非正态分布数据:中位数(四分位距)
-
分类变量:百分比表示
青春期分期标准
根据GnRHa治疗启动时的青春期阶段分组:
-
跨性别女性(按睾丸体积分期):
-
早期:≤9 mL
-
中期:10-19 mL
-
晚期:≥20 mL
(左右睾丸不一致时取最大值)
-
-
跨性别男性(按Tanner乳房分期):
-
早期:B2期
-
中期:B3期
-
晚期:B4-B5期
-
分析方法
-
参考数据处理:因参考数据集限制,无法直接比较HSA绝对值。计算各青春期组在三个时间点(GnRHa启动时、GAH启动时、GAH≥2年时)的中位年龄,将对应年龄的HSA参考值绘制于图表中进行比较。
-
BMI变化分析:采用回归分析比较三组间BMI变化差异,排除BMI数据缺失者
-
主要结局指标分析:
-
采用线性混合模型分析骨膜宽度和皮质内直径的变化
-
固定效应:三个时间点
-
随机效应:受试者内重复测量(含随机截距)。通过-2对数似然比检验选择最优模型(是否包含随机斜率)
-
-
协变量调整:吸烟状态(从未吸烟 vs 既往/当前吸烟)作为交互项纳入模型。因吸烟者数量不足,跨性别男性早/中期组未进行此项调整。晚期跨性别男性及所有跨性别女性亚组中,吸烟状态对结局无显著影响。吸烟数据缺失者不纳入调整分析。
-
缺失数据处理:主要结局指标采用混合模型处理缺失数据。自变量缺失情况见表1和2脚注
表1. 跨性别女性基线特征
| 特征参数 | 早期青春期 (n=32) | 中期青春期 (n=30) | 晚期青春期 (n=44) |
|---|---|---|---|
| 年龄(岁) | |||
| GnRHa启动时 | 13.1 (12.5; 13.5) | 13.4 (12.9; 14.9) | 15.5 (14.3; 16.6) |
| GAH启动时 | 15.7 (15.3; 16.0) | 16.0 (15.8; 16.6) | 16.4 (16.0; 17.4) |
| GAH治疗≥2年时DXA检测 | 19.5 (18.1; 20.4) | 19.6 (19.0; 20.3) | 21.0 (20.4; 22.6) |
| 治疗持续时间(年) | |||
| GnRHa单药治疗 | 2.6 (2.1; 3.0) | 2.3 (1.5; 2.8) | 1.0 (0.7; 1.9) |
| GAH治疗(至≥2年DXA时) | 3.7 (2.7; 4.8) | 3.8 (2.7; 4.5) | 4.3 (3.4; 6.2) |
| 性腺切除(GAH≥2年DXA前) | 11 (34.4%) | 11 (36.7%) | 20 (45.5%) |
| BMI(kg/m²) | |||
| GnRHa启动时 | 17.7 (16.6; 20.3) | 18.0 (16.9; 19.7) | 19.0 (17.6; 25.1) |
| GAH启动时 | 20.0 (17.3; 22.0) | 19.8 (18.3; 21.2) | 20.4 (18.9; 23.1) |
| GAH≥2年时 | 21.8 (18.1; 25.4) | 20.7 (18.7; 25.4) | 22.9 (19.7; 26.0) |
| 身高(cm) | |||
| GnRHa启动时 | 158 (154; 163) | 165 (154; 172) | 173 (167; 180) |
| GAH启动时 | 173 (169; 177) | 171 (166; 175) | 173 (170; 182) |
| GAH≥2年时 | 182 (180; 185) | 180 (175; 189) | 178 (175; 185) |
| 种族(白人占比) | 100% | 100% | 93.2% |
| 吸烟(是) | 10% | 20.7% | 17.1% |
| 雌二醇(pmol/L) | |||
| GnRHa启动时 | <20 (<20; <20) | <20 (<20; <20) | 64.7 (<20; 91.0) |
| GAH启动时 | <20 (<20; <20) | <20 (<20; <20) | <20 (<20; <20) |
| GAH≥2年时 | 161 (99; 419) | 215 (121; 395) | 156 (116; 237) |
| 睾酮(nmol/L) | |||
| GnRHa启动时 | 3.7 (1.8; 6.9) | 8.8 (4.6; 13.1) | 15.8 (11.8; 21) |
| GAH启动时 | 1.3 (1.3; 1.3) | 1.3 (1.3; 1.3) | 1.3 (1.3; 1.3) |
| GAH≥2年时 | 0.8 (0.5; 1.3) | 0.7 (0.5; 1.1) | 0.8 (0.6; 1.3) |
注释:
-
数据表示:中位数(四分位距),青春期分期标准(基于GnRHa启动时睾丸体积):早期:≤9 mL,中期:10-19 mL,晚期:≥20 mL
-
缺失数据:1名中期青春期受试者在GAH启动时及≥2年时的BMI/身高数据缺失。吸烟状态:早期2名、中期1名、晚期3名受试者数据缺失
-
检测限:雌二醇最低检测浓度为20 pmol/L
该表格显示:晚期青春期启动GnRHa的跨性别女性基线睾酮水平显著更高(15.8 vs 3.7-8.8 nmol/L),但经GAH治疗后所有组别睾酮均被有效抑制至1.3 nmol/L以下。雌二醇水平在GAH治疗≥2年后达到生理女性范围(156-215 pmol/L)
表2. 跨性别男性基线特征
| 特征参数 | 早期青春期 (n=8) | 中期青春期 (n=22) | 晚期青春期 (n=186) |
|---|---|---|---|
| 年龄(岁) | |||
| GnRHa启动时 | 11.9 (11.8; 12.0) | 12.5 (12.1; 13.0) | 15.7 (14.6; 16.8) |
| GAH启动时 | 15.9 (15.7; 15.9) | 15.9 (15.4; 16.0) | 16.5 (16.0; 17.5) |
| GAH治疗≥2年时DXA检测 | 19.4 (18.3; 21.0) | 19.0 (18.1; 20.5) | 20.7 (19.3; 22.9) |
| 治疗持续时间(年) | |||
| GnRHa单药治疗 | 3.9 (3.5; 4.1) | 3.1 (2.9; 3.5) | 0.9 (0.6; 1.7) |
| GAH治疗(至≥2年DXA时) | 3.5 (2.5; 5.1) | 3.1 (2.9; 4.1) | 4.0 (2.7; 6.3) |
| 性腺切除(GAH≥2年DXA前) | 4 (50%) | 8 (36.4%) | 61 (32.8%) |
| BMI(kg/m²) | |||
| GnRHa启动时 | 15.6 (15.6; 15.6) | 17.8 (16.0; 19.5) | 21.5 (19.4; 23.9) |
| GAH启动时 | 18.7 (16.7; 21.2) | 20.3 (18.7; 21.8) | 22.1 (20.5; 25.6) |
| GAH≥2年时 | 22.5 (20.7; 24.3) | 21.8 (20.9; 25.9) | 23.6 (22.3; 26.3) |
| 身高(cm) | |||
| GnRHa启动时 | 160 (160; 160) | 154 (152; 163) | 166 (160; 172) |
| GAH启动时 | 164 (156; 172) | 167 (156; 170) | 167 (162; 171) |
| GAH≥2年时 | 173 (162; 180) | 171 (165; 175) | 168 (163; 173) |
| 种族(白人比例) | 100% | 100% | 92.5% |
| 吸烟(是) | 12.5% | 5% | 23.3% |
| 雌二醇(pmol/L) | |||
| GnRHa启动时 | 143 (31; 197) | 118 (29; 175.4) | 189 (95; 389) |
| GAH启动时 | <20 (<20; 25) | <20 (<20; <20) | <20 (<20; <20) |
| GAH≥2年时 | 34 (27; 86) | 78 (53; 99) | 84 (43; 125) |
| 睾酮(nmol/L) | |||
| GnRHa启动时 | 1.3 (1.3; 1.5) | 1.3 (1.3; 1.3) | 1.3 (1.3; 1.5) |
| GAH启动时 | 0.7 (0.5; 1.3) | 1.3 (0.9; 1.3) | 1.3 (1.3; 1.3) |
| GAH≥2年时 | 8.3 (5.5; 31) | 21 (16; 29) | 15.4 (9.5; 26) |
注释:
-
数据表示:中位数(四分位距),青春期分期标准(基于GnRHa启动时Tanner乳房分期):早期:B2期,中期:B3期,晚期:B4-B5期
-
缺失数据:1名中期青春期受试者在GAH≥2年时的BMI/身高数据缺失
-
检测限:雌二醇最低检测浓度为20 pmol/L
关键发现:
-
治疗时机:早期组GnRHa启动年龄最小(11.9岁),单药治疗时间最长(3.9年)
-
激素水平:GAH治疗≥2年后,睾酮达生理男性水平(中位数8.3-21 nmol/L),雌二醇在GnRHa治疗后显著抑制(<20 pmol/L),GAH后维持在较低水平
-
体格变化:所有组别GAH治疗后BMI均增加,身高增长在早期组最明显(160→173 cm)
使用STATA 15.1(StataCorp LLC, USA)进行数据分析
参与者特征
共纳入322名参与者,其中跨性别女性(trans women):106人,跨性别男性(trans men):216人
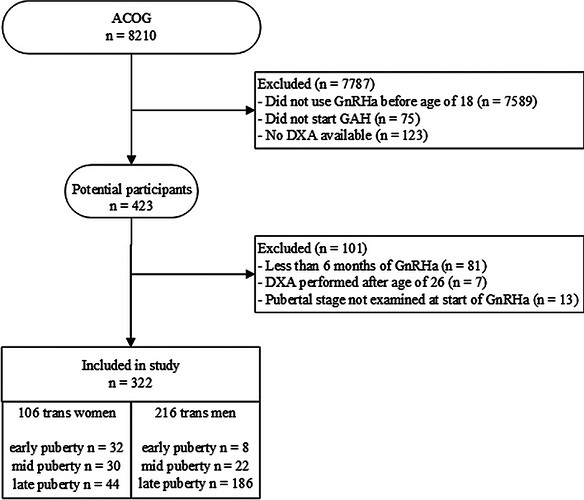
流程图:纳入流程见图2
数据呈现:表1和表2分别展示跨性别女性与跨性别男性的基线特征(按GnRHa治疗启动时的青春期阶段分组)提供以下关键数据:GnRHa治疗启动年龄,单一GnRHa治疗持续时间,性别肯定激素治疗(GAH)启动年龄,接受≥2年GAH后DXA检测时的年龄,三个时间点的雌二醇/睾酮浓度
治疗规范:根据临床方案,参与者在以下两个时间点之间符合性腺切除术医学指征:GAH启动时的DXA检测,接受≥2年GAH后的DXA检测
补充数据:115名参与者在完成≥2年GAH前的DXA检测前已接受性腺切除术。同时提供种族构成与BMI基线数据
统计学发现:无论是跨性别女性还是跨性别男性,不同 puberty groups(青春期阶段组)间的BMI随时间变化均无显著差异
图2
ACOG = 阿姆斯特丹性别焦虑队列(Amsterdam Cohort of Gender Dysphoria),GnRHa = 促性腺激素释放激素类似物(gonadotropin-releasing hormone analogue),GAH = 性别肯定激素治疗(gender-affirming hormone treatment),DXA = 双能X射线吸收测定法(dual-energy X-ray absorptiometry)
HSA(髋骨结构分析)参数:股骨颈狭窄部位
研究结果
-
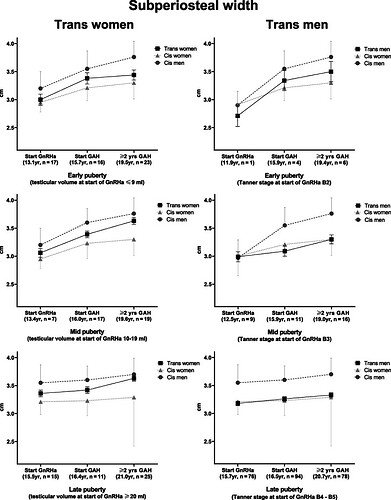
图2 & 图3 分别展示跨性别女性(trans women)和跨性别男性(trans men)的以下指标变化:骨膜下宽度(subperiosteal width)皮质内径(endocortical diameter)数据来源于线性混合模型分析(linear mixed-model analyses)
-
纳入分析的观察值数量:
-
跨性别女性(按青春期阶段分组):
-
早期青春期组(early puberty):56 例
-
中期青春期组(mid puberty):43 例
-
晚期青春期组(late puberty):51 例
-
-
跨性别男性(按青春期阶段分组):
-
早期青春期组:11 例
-
中期青春期组:36 例
-
晚期青春期组:248 例
-
-
-
参考数据:图中同时提供从文献中提取的顺性别人群参考值以供对比。
-
表3 数据总结:绝对数值(基于股骨颈狭窄部位HSA测量):GnRHa治疗启动时的骨膜下宽度与皮质内径,GAH启动时的变化,接受≥2年GAH后的发育情况
图3
骨膜下宽度(Subperiosteal Width)在单一GnRHa治疗期间及GAH启动后的变化(基于混合模型分析数据,并与顺性别群体参考值对比)
数据分析图示说明:左图面板:跨性别女性(Trans Women)右图面板:跨性别男性(Trans Men)上方面板:GnRHa治疗始于早期青春期的参与者。中间面板:GnRHa治疗始于中期青春期的参与者。下方面板:GnRHa治疗始于晚期青春期的参与者。括号内数值:各青春期组的中位年龄
青春期阶段定义标准:跨性别女性:早期青春期:GnRHa启动时睾丸体积 ≤9 mL,中期青春期:GnRHa启动时睾丸体积 10–19 mL,晚期青春期:GnRHa启动时睾丸体积 ≥20 mL。跨性别男性:早期青春期:GnRHa启动时Tanner分期为 B2,中期青春期:GnRHa启动时Tanner分期为 B3,晚期青春期:GnRHa启动时Tanner分期为 B4–B5
表3:跨性别女性与跨性别男性的骨膜下宽度及皮质内径变化(厘米)
(基于线性混合模型分析数据)测量指标说明:骨膜下宽度(Subperiosteal width),皮质内径(Endocortical diameter),数据格式:均值(95%置信区间)
跨性别女性(Trans Women)
早期青春期组(GnRHa启动时睾丸体积 ≤9 mL)
| 指标 | GnRHa启动时 | GnRHa启动至GAH启动的变化(Δ) | GnRHa启动至GAH≥2年的变化(Δ) | GAH启动至GAH≥2年的变化(Δ) |
|---|---|---|---|---|
| 骨膜下宽度 | 3.00 (2.81; 3.19) | 0.38 (0.16; 0.60) | 0.44 (0.23; 0.65) | 0.06 (−0.15; 0.27) |
| 皮质内径 | 2.68 (2.49; 2.87) | 0.39 (0.16; 0.61) | 0.38 (0.17; 0.60) | −0.00 (−0.21; 0.21) |
中期青春期组(GnRHa启动时睾丸体积 10–19 mL)
| 骨膜下宽度 | 3.06 (2.89; 3.23) | 0.33 (0.15; 0.50) | 0.57 (0.39; 0.75) | 0.25 (0.11; 0.38) |
| 皮质内径 | 2.73 (2.56; 2.89) | 0.34 (0.17; 0.51) | 0.55 (0.37; 0.72) | 0.21 (0.08; 0.34) |
晚期青春期组(GnRHa启动时睾丸体积 ≥20 mL)
| 骨膜下宽度 | 3.36 (3.25; 3.47) | 0.06 (−0.08; 0.20) | 0.27 (0.16; 0.39) | 0.21 (0.09; 0.34) |
| 皮质内径 | 2.98 (2.86; 3.09) | 0.08 (−0.06; 0.22) | 0.27 (0.15; 0.40) | 0.19 (0.06; 0.33) |
跨性别男性(Trans Men)
早期青春期组(GnRHa启动时Tanner分期 B2)
| 指标 | GnRHa启动时 | GnRHa启动至GAH启动的变化(Δ) | GnRHa启动至GAH≥2年的变化(Δ) | GAH启动至GAH≥2年的变化(Δ) |
|---|---|---|---|---|
| 骨膜下宽度 | 2.71 (2.35; 3.07) | 0.63 (0.58; 0.68) | 0.79 (0.72; 0.85) | 0.15 (0.12; 0.19) |
| 皮质内径 | 2.39 (2.02; 2.76) | 0.62 (0.57; 0.67) | 0.73 (0.67; 0.79) | 0.11 (0.08; 0.14) |
中期青春期组(GnRHa启动时Tanner分期 B3)
| 指标 | GnRHa启动时 | GnRHa启动至GAH启动的变化(Δ) | GnRHa启动至GAH≥2年的变化(Δ) | GAH启动至GAH≥2年的变化(Δ) |
|---|---|---|---|---|
| 骨膜下宽度 | 2.99 (2.81; 3.17) | 0.10 (−0.09; 0.29) | 0.31 (0.11; 0.50) | 0.21 (0.03; 0.38) |
| 皮质内径 | 2.66 (2.46; 2.85) | 0.09 (−0.11; 0.30) | 0.27 (0.06; 0.48) | 0.18 (−0.01; 0.36) |
晚期青春期组(GnRHa启动时Tanner分期 B4–B5)
| GnRHa启动时 | GnRHa启动至GAH启动的变化(Δ) | GnRHa启动至GAH≥2年的变化(Δ) | GAH启动至GAH≥2年的变化(Δ) |
|---|---|---|---|
| 骨膜下宽度 | 3.18 (3.10; 3.27) | 0.07 (−0.03; 0.18) | 0.15 (0.04; 0.26) | 0.07 (−0.04; 0.18) |
| 皮质内径 | 2.80 (2.71; 2.89) | 0.10 (−0.01; 0.21) | 0.17 (0.05; 0.28) | 0.07 (−0.04; 0.17) |
关键发现
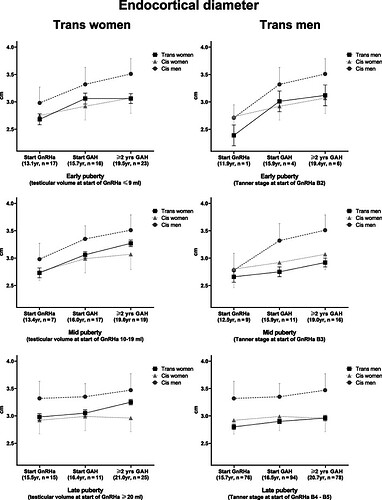
-
青春期阶段依赖性差异(图3-4):仅在早期青春期启动GnRHa的跨性别者(无论女性或男性),其骨几何形态变化曲线趋近于经验性别(experienced gender)的参考曲线。中/晚期青春期启动治疗者,骨形态仍接近出生指定性别(gender assigned at birth)的参考曲线。
-
变化幅度:跨性别男性在早期青春期组的骨膜下宽度增长最显著(Δ 0.79 cm,95% CI 0.72–0.85)。跨性别女性在晚期青春期组的骨变化最小(Δ 0.27 cm,95% CI 0.16–0.39)
图4
皮质内径变化分析:GnRHa单药治疗期与GAH启动后的动态演变。研究方法与数据可视化(基于混合效应模型分析的纵向数据)
图表结构说明:性别对比面板:左面板:跨性别女性(trans women)队列数据,右面板:跨性别男性(trans men)队列数据:青春期启动阶段分层:上层面板:早期青春期启动GnRHa治疗组,中层面板:中期青春期启动组,下层面板:晚期青春期启动组
参考数据体系:顺性别对照数据引自Alwis等学者研究(文献16):顺性别女性(cis women)参考曲线,顺性别男性(cis men)参考曲线
关键参数定义,青春期阶段划分标准:跨性别女性组:早期青春期:GnRHa起始时睾丸体积≤9mL,中期青春期:睾丸体积10-19mL,晚期青春期:睾丸体积≥20mL
跨性别男性组:早期青春期:Tanner分期B2期,中期青春期:Tanner分期B3期,晚期青春期:Tanner分期B4-B5期
年龄标注:各青春期组中位年龄标注于括号内
研究讨论与结论
本研究结果显示,在早期青春期开始接受促性腺激素释放激素类似物(GnRHa)治疗的参与者,在性别肯定激素治疗(GAH)期间其骨膜下宽度和皮质内径的变化更接近其经验性别的发育模式。既往关于接受青春期抑制治疗的跨性别青少年骨健康研究主要集中于骨密度指标。2015年Klink等学者对34例接受GnRHa和GAH治疗的跨性别青少年进行骨密度(BMD)发育研究[14],发现两组人群在GnRHa治疗期间绝对骨量均下降。虽然开始GAH后绝对骨量有所增加,但长期随访显示面积骨密度Z值仍低于治疗前水平。2017年Vlot等学者报道了GnRHa和GAH治疗期间骨转换标志物与骨量的关系[20],发现GnRHa治疗期间骨转换率和骨矿物表观密度(BMAD)Z值均下降。治疗24个月后,除骨龄≥14岁的跨性别男性亚组外,其余参与者骨转换率进一步降低。与之相反的是,所有参与者在GAH治疗期间BMAD Z值均有所升高,但正如2015年研究所示,Z值仍未恢复至治疗前水平。尽管关于跨性别青少年骨密度发育的认识不断深入,但该特定人群的骨几何形态特征仍是未被探索的研究领域。
本研究中在青春期中期或晚期开始治疗的参与者,其骨几何形态更接近出生指定性别的参考曲线。这表明睾酮和雌激素对骨膜和皮质内骨生长的主要影响发生在青春期早期。这种现象可能用"编程效应"理论来解释。编程效应理论认为,在发育关键窗口期受到的外界刺激可对个体终身产生重大影响。Barker等学者的系列研究为该理论奠定了基础[21-23],这些研究表明产前和婴幼儿期营养不良导致的低出生体重和体格发育迟缓,与成年期心血管疾病高风险相关。该理论现被称为"健康与疾病发育起源"(DOHaD)学说。1959年提出的与DOHaD相似的"组织-激活假说"在行为科学领域也得到广泛认可,该假说认为类固醇激素在发育敏感期调控脑结构组织,并可能在青春期和成年期激活相关行为[24]。这两个理论最初主要关注胎儿期和围产期刺激的影响,而近期研究表明青春期可能是另一个重要的编程或组织窗口期[25-28]。我们的研究结果支持这一观点。此外,这一思路与既往关于成年跨性别者骨几何形态的研究结果一致[12,29,30]。与本研究中青春期中期和晚期组类似,这些研究中成年跨性别者的各项几何参数均未向其经验性别转变,提示可能已经错过了调控性别特异性骨发育的窗口期。另一种解释是,由于这些研究的参与者均已达到峰值骨量,性激素可能不再影响骨结构重塑。然而,阐明青春期阶段对性别特异性骨几何发育的显著影响机制已超出本研究范围,需要进一步探索。
睾酮和雌激素对骨几何形态的作用已被确认,但其具体效应尚未完全阐明。20世纪后半叶,Garn等学者通过掌骨二维放射影像研究发现,青春期骨膜沉积存在性别二态性[7],顺性别男性青少年的骨膜沉积显著多于顺性别女性。与之相反,顺性别女性青春期皮质内沉积更多,这可能是由雌激素驱动。Gabel等学者近期基于外周定量CT的研究证实了睾酮对骨膜生长的促进作用,但对雌激素驱动的皮质内沉积假说提出了不同见解[31]。该研究发现顺性别女性的皮质内吸收少于顺性别男性,作者认为这种差异可能源于研究解剖部位的不同。由于不同骨骼部位承受的力学负荷存在差异,骨代谢呈现区域异质性:Garn的研究基于非负重部位的掌骨,而后者研究则评估了胫骨指标。这提示我们应当重视机械力的影响,特别是在本研究中GAH已证实会影响跨性别青少年的肌肉量和体重[32]。根据Frost力学调控理论,肌肉力量的变化可能通过改变机械负荷影响骨几何形态[33],睾酮通过增加肌肉量提升机械负荷,从而刺激骨膜生长。因此,骨几何形态的性别特异性变化很可能不仅是性激素的直接作用,而是力学与激素调控共同作用的结果。遗憾的是,本研究未能获取DXA检测时的握力数据来验证这一假说。
本研究存在若干局限性。首先,缺乏标准化的HSA参数参考数据集。通过文献检索,我们发现两项相关研究:一项报道了中国15-91岁人群股骨颈HSA参数[34],但由于生活方式、遗传背景差异及缺乏合适年龄分层,该数据不适合作为参考;另一项基于瑞典人群的研究[16]在种族构成上更接近我们的研究人群(均为白种人)。由于数据缺失,我们无法比较营养状况、体力活动、钙或维生素D摄入等其他可能影响骨几何形态的因素。但既往研究表明,成年跨性别者在GAH治疗前的体力活动水平与顺性别对照组相当[30,35],而维生素D研究显示跨性别女性的25-羟维生素D水平显著低于顺性别男性,跨性别男性则与顺性别女性相近[30,35]。Alwis等学者使用的DXA设备(Lunar)与本研究的Hologic设备存在差异[16],前者采用笔形束扫描,后者使用扇形束技术,因此无法直接比较绝对值。目前文献中缺乏两家厂商HSA参数的比较研究,但我们认为曲线变化趋势仍具有可比性——这恰好符合本研究关注骨几何形态时序变化的宗旨。需注意的是,瑞典数据集按年龄分组而非青春期分期,但通过各年龄段的Tanner分期分布对比,我们发现其与本研究GnRHa起始时的发育阶段高度吻合,从而实现了基于发育阶段的骨几何变化比较。
其次,DXA测量骨几何形态存在技术局限性。HSA参数是从二维图像重建的三维测量指标,髋部摆放位置的差异可能导致测量误差。但所有扫描均由经过培训的技术人员按操作规程完成,最大程度减少了潜在误差。与三维测量的金标准定量CT(QCT)相比,多项研究证实DXA衍生的HSA参数具有高度相关性[36,37],这些研究采用的Hologic设备与本研究相同,为HSA的有效性提供了支持。
第三,并非所有参与者都完成了全部三个预设时间点的DXA扫描。但通过混合模型分析对缺失数据进行随机填补[19],在保持最大样本量的同时将缺失数据的影响降至最低。最后,由于早期青春期跨性别男性样本量较小(n=11),难以就该亚组得出确定性结论。这种差异源于跨性别男性(出生指定性别为女性)的青春期启动年龄早于跨性别女性,当完成诊断流程时,多数跨性别男性已度过青春期早期。虽然我们无法增加该亚组的样本量,但没有证据表明现有样本不能代表该群体。
如前所述,既往研究已探讨过GnRHa和GAH治疗期间骨密度及骨转换标志物的变化规律[14,20]。但骨密度仅是骨强度的维度之一,骨几何形态和材料特性同样重要。因此,本研究为理解青春期性别特异性骨发育提供了新的视角。我们发现,只有当GnRHa治疗始于青春期早期并后续启动GAH时,骨几何发育方向才会发生转变。这对骨折风险评估可能具有重要临床意义。Duan等学者曾证实,老年髋部骨折风险的性别差异与性别二态性骨几何特征相关[2]——年轻顺性别男性骨皮质距中性轴的距离更大,从而提供更强的抗弯曲能力。但目前尚无针对跨性别群体长期骨折风险的研究。我们可以推测,若在青春期早期接受抑制治疗的跨性别女性获得与顺性别女性相似的骨几何形态,其骨折风险也可能趋于一致,但这需要后续研究验证。另一个潜在研究方向是探索HSA变化与骨转换标志物的关联,可通过比较相似人群的骨形成与吸收标志物来实现。此外,我们的结果也为普通人群青春期性激素对骨几何发育的编程效应研究提出了新问题。
综上所述,当GnRHa治疗始于青春期早期并后续启动GAH时,跨性别青少年的髋骨几何发育更接近其经验性别模式。仅早期青春期开始治疗的参与者表现出与其经验性别参考曲线的相似性,而青春期中期或晚期开始治疗者仍基本保持出生指定性别的发育轨迹。